Equações Químicas: Representando Reações Químicas: As Equacoes Quimicas Representam Reacoes Quimicas Como O Exemplo Abaixo
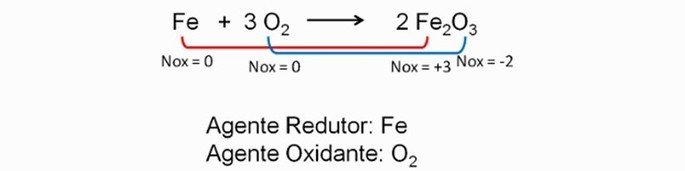
As Equacoes Quimicas Representam Reacoes Quimicas Como O Exemplo Abaixo – As equações químicas são ferramentas essenciais na química, fornecendo uma representação concisa e precisa das reações químicas. Elas permitem-nos visualizar os reagentes que se transformam em produtos, quantificar as substâncias envolvidas e prever o resultado de uma reação. O balanceamento dessas equações é crucial para garantir a conformidade com a lei da conservação da massa.
Introdução às Equações Químicas
A principal função de uma equação química é representar, de forma simbólica, o que ocorre durante uma reação química. Ela mostra quais substâncias reagem (reagentes) e quais substâncias são formadas (produtos), além de indicar as proporções em que essas substâncias estão envolvidas. O balanceamento é fundamental, pois garante que o número de átomos de cada elemento seja o mesmo nos reagentes e nos produtos, respeitando a lei da conservação da massa.
A equação balanceada fornece informações quantitativas precisas sobre a reação.
Símbolos e notações específicas são utilizados para descrever o estado físico das substâncias: (s) para sólido, (l) para líquido, (g) para gasoso e (aq) para aquoso (dissolvido em água). Compreender esses símbolos é essencial para a interpretação completa da equação.
| Símbolo | Significado | Exemplo | Observação |
|---|---|---|---|
| (s) | Sólido | NaCl(s) | Representa o estado físico sólido do cloreto de sódio. |
| (l) | Líquido | H₂O(l) | Indica que a água está no estado líquido. |
| (g) | Gasoso | CO₂(g) | Mostra que o dióxido de carbono é um gás. |
| (aq) | Aquoso | NaOH(aq) | Significa que o hidróxido de sódio está dissolvido em água. |
Tipos de Reações Químicas Representadas
As reações químicas podem ser classificadas em diversos tipos, cada um com características específicas. A compreensão dessas classificações auxilia na previsão do comportamento de diferentes substâncias e na análise de reações complexas. Aqui, analisaremos alguns tipos comuns, ilustrando-os com exemplos de equações químicas balanceadas.
- Síntese: A + B → AB. Exemplo: 2H₂(g) + O₂(g) → 2H₂O(l)
- Decomposição: AB → A + B. Exemplo: 2H₂O₂(l) → 2H₂O(l) + O₂(g)
- Simples Troca: A + BC → AC + B. Exemplo: Zn(s) + 2HCl(aq) → ZnCl₂(aq) + H₂(g)
- Dupla Troca: AB + CD → AD + CB. Exemplo: AgNO₃(aq) + NaCl(aq) → AgCl(s) + NaNO₃(aq)
Reações de síntese e decomposição são opostas. Síntese envolve a combinação de substâncias para formar uma mais complexa, enquanto decomposição é a quebra de uma substância em outras mais simples. A diferença principal reside na natureza dos reagentes e produtos: síntese tem reagentes mais simples e produto mais complexo, enquanto a decomposição apresenta o oposto.
| Tipo de Reação | Equação Química Balanceada | Descrição |
|---|---|---|
| Síntese | N₂(g) + 3H₂(g) → 2NH₃(g) | Combinação de nitrogênio e hidrogênio para formar amônia. |
| Decomposição | CaCO₃(s) → CaO(s) + CO₂(g) | Decomposição do carbonato de cálcio em óxido de cálcio e dióxido de carbono. |
| Simples Troca | Fe(s) + CuSO₄(aq) → FeSO₄(aq) + Cu(s) | Ferro desloca o cobre do sulfato de cobre. |
Interpretação da Equação Química Exemplar, As Equacoes Quimicas Representam Reacoes Quimicas Como O Exemplo Abaixo
Vamos considerar a equação: 2HCl(aq) + Mg(s) → MgCl₂(aq) + H₂(g). Nessa reação, o ácido clorídrico (HCl) reage com magnésio metálico (Mg) para produzir cloreto de magnésio (MgCl₂) e gás hidrogênio (H₂). O HCl e o MgCl₂ estão em solução aquosa, enquanto o Mg é sólido e o H₂ é gasoso. A reação envolve uma transferência de elétrons, onde o magnésio é oxidado e o hidrogênio é reduzido.
Passo a passo: Íons H⁺ do ácido clorídrico reagem com o magnésio sólido, transferindo elétrons para o magnésio e formando íons Mg²⁺ e H₂. Os íons Mg²⁺ e Cl⁻ formam o cloreto de magnésio em solução aquosa, e o gás hidrogênio é liberado.
Aplicações das Equações Químicas

As equações químicas são ferramentas imprescindíveis em diversas áreas. Em cálculos estequiométricos, elas permitem determinar as quantidades de reagentes e produtos envolvidos numa reação. Por exemplo, a equação 2H₂ + O₂ → 2H₂O indica que 2 mols de H₂ reagem com 1 mol de O₂ para produzir 2 mols de H₂O. Na indústria química, as equações guiam o controle de processos e otimização da produção.
Na medicina, o conhecimento de reações químicas é crucial para o desenvolvimento de fármacos e a compreensão de processos metabólicos.
Através das equações químicas, podemos prever o resultado de uma reação química, permitindo a escolha de condições otimizadas para a obtenção do produto desejado. Por exemplo, em síntese orgânica, a previsão da formação de um isômero específico pode ser feita com base na compreensão das reações envolvidas.
Representação Visual da Reação Química
Na reação 2HCl(aq) + Mg(s) → MgCl₂(aq) + H₂(g), visualmente, podemos imaginar átomos de Mg dispersos, interagindo com moléculas de HCl na solução. Os íons H⁺ se aproximam do Mg, e ocorre a transferência de elétrons, formando íons Mg²⁺ e moléculas de H₂ que se liberam como gás. Os íons Mg²⁺ e Cl⁻ permanecem em solução, formando o cloreto de magnésio.
A liberação do gás hidrogênio é um indicativo visual da ocorrência da reação.
A formação de uma solução incolor (se o MgCl₂ for incolor) indica a formação do produto.
Essa representação visual, embora simplificada, auxilia na compreensão do rearranjo atômico durante a reação, tornando o processo químico mais intuitivo e fácil de assimilar.
Em resumo, as equações químicas são a chave para desvendar os mistérios das reações químicas. Dominar sua interpretação é fundamental para qualquer estudante ou profissional da área. De processos simples a complexas sínteses industriais, a capacidade de ler, entender e aplicar as equações químicas abre portas para inovação e compreensão mais profunda do mundo que nos cerca. A precisão e o poder preditivo dessas representações nos mostram a beleza e a elegância da química, uma ciência que transforma e impulsiona o progresso.

